Em primeiro lugar, é importante entender que a química não sofreu mudança alguma. A IUPAC, União Internacional de Química Pura e Aplicada, resolveu fazer uma "maquiagem" na Tabela Periódica.
Quando localizamos um elemento na tabela periódica, três informações são mostradas com mais ênfase: o símbolo do elemento, seu número atômico e sua massa atômica. O elemento Boro, por exemplo, tem símbolo B, número atômico 5 e massa atômica igual a 10,811 unidades. O nome e o símbolo do elemento é decidido pela IUPAC em longos processos de consenso entre os membros da comissão responsável (elementos descobertos na última década estão ainda sem nome definitivo). O número atômico é igual ao número de prótons que o átomo possui em seu núcleo, portanto trata-se de um valor exato, inteiro e indiscutível (uma vez determinado corretamente). A mudança proposta diz respeito à massa atômica.
 |
| Fragmento de uma tabela periódica do tipo geralmente usado pelos estudantes do ensino médio. Observe o número atômico, o símbolo químico e a massa atômica. |
Não existe um único tipo de átomo de boro na natureza. Existem "boros" que possuem 5 prótons e 5 nêutrons em seu núcleo; e existem os que apresentam 5 prótons e 6 nêutrons em seu núcleo. Simplificadamente, assumimos que a massa dos prótons e nêutrons seja rigorosamente idêntica. Sendo assim, existem átomos de boro de número de massa 10 (5+5) e de número de massa 11 (5+6). O número de massa, então, também tem um valor exato, inteiro e indiscutível.
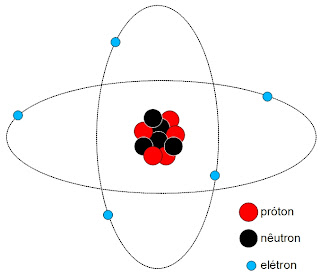 |
| Representação simplicada de um átomo de boro-10. |
A questão em pauta diz respeito à diferença entre número de massa e massa atômica. Enquanto o número de massa refere-se a um átomo isolado, a massa atômica se refere a uma amostra de átomos. Se você pudesse isolar e examinar um átomo de boro, iria perceber que ele ou tem número de massa 10 ou número de massa 11. Acontece que nós não manuseamos átomos isolados. Se você vai fazer reagir o elemento boro com algum outro elemento, a sua amostra de átomos de boro terá átomos dos dois tipos, ou seja boro-10 e boro-11, chamados de isótopos do boro. Daí surgiu a necessidade de se estabelecer uma “massa média” para o boro. É mais ou menos a mesma coisa que assumir que a “massa média de uma pessoa é igual a 70 kg”, como vemos em muitos elevadores: “capacidade 6 pessoas ou 420 kg”. Imagino que esse valor de 70 kg deva ter sido calculado a partir de uma média das massas dos usuários de elevador.
A massa atômica é calculada a partir da média dos números de massa dos elementos, levando-se em consideração a proporção existente na natureza entre os seus diversos isótopos. O boro-10 e o boro-11, por exemplo, correspondem respectivamente e aproximadamente a 20% e 80% dos tipos de átomos de boro presentes na natureza. O cálculo da massa atômica é a média aritmética ponderada entre esses dois valores, ou seja: [(10x20) + (11x80)] / 100. O valor encontrado será 10,8 unidades e é definido como sua massa atômica.
Não precisa ser gênio para perceber que o problema é a determinação da composição isotópica do elemento, ou seja, “quantos porcento de boro-10 e quantos porcento de boro-11 existem na natureza”. A composição isotópica varia conforme a amostra obtida na natureza. O que se está tentando fazer é tornar claro que a massa atômica do boro obtido no Brasil pode ser diferente da massa atômica do boro obtido no Japão, ou seja, os percentuais de cada isótopo do boro podem ser diferentes conforme a sua origem. A coisa vai mais adiante, é claro. A composição isotópica ou abundância relativa do boro no planeta Terra não deve ser a mesma da existente no planeta Marte. Isso já sabemos faz tempo! Aliás, a confirmação da origem extraterrestre de meteoritos é feita exatamente pela determinação da composição isotópica dos mesmos, diferente da composição encontrada aqui na Terra. Em outras palavras: uma tabela periódica terrestre e uma tabela periódica marciana teriam massas atômicas diferentes para os mesmos elementos.
A IUPAC agora quer oficializar essa diversidade na Tabela Periódica. Tudo bem! Só não concordo que se trate isso como uma grande descoberta e principalmente como uma inovação.
As notícias divulgadas pela instituição (clique aqui) dão conta dos elementos hidrogênio, lítio, boro, carbono, nitrogênio, oxigênio, silício, cloro, enxofre e tálio. Tais elementos passarão a ter suas massas atômicas grafadas como intervalos (e os outros? serão notícia no futuro?). O boro, por exemplo, terá sua massa indicada como o intervalo entre 10,806 e 10,821. Como a gigantesca maioria dos estudantes de química trabalha com tabelas simplificadas, onde o valor da massa atômica é dado como 10,8, a mudança não tem a menor relevância para eles. O enxofre (S) mudará de 32,065 para o intervalo entre 32,059 e 32,076. Apenas os químicos que trabalham com as tabelas técnicas, usadas para cálculos de precisão em laboratórios de análises ultraquantitativas é que serão afetados pela mudança... e continuarão sem saber qual massa usar (essa é a parte incrível da “novidade”), a não ser que a IUPAC publique uma outra tabela indicando qual massa atômica usar para uma determinada amostra que se conheça a procedência.
"Por mais de um século e meio, muitos foram ensinados a usar massas atômicas padronizadas - um valor único - encontrado nas capas dos livros didáticos de química e na tabela periódica dos elementos", disse Ty Coplen, diretor do Reston Stable Isotope Laboratory. "Embora essa mudança ofereça benefícios significativos na compreensão da química, pode-se imaginar o desafio, agora, aos educadores e estudantes que terão que selecionar um único valor de um intervalo ao fazer cálculos de química."*
"Nós esperamos que os químicos e os educadores tomem este desafio como uma oportunidade única para incentivar o interesse dos jovens em química e gerar entusiasmo para o futuro criativo da química," afirma a doutora Fabienne Meyers, diretora adjunta da IUPAC.*
Grifos anteriores, por minha conta. Desafio? Oportunidade única? Incentivar o interesse? Entusiasmo? Futuro criativo? Calma aí, né gente. Menos... menos... Bons professores, bons laboratórios farão isso de maneira muito mais eficiente.
2011 é o Ano Internacional da Química. A mudança na Tabela Periódica tem sido vista como uma tentativa de aproximar as pessoas ainda mais da química. Sinceramente, não vejo como isso muda alguma coisa. A tabela periódica é uma das descobertas mais interessantes da química em todos os tempos, mas “de uso exclusivo das forças químicas”, ou seja, não tem muito sentido fora das salas de aula e dos laboratórios. Para chegar até a compreensão dessas mudanças e enxergar alguma beleza nelas, é preciso primeiro ingressar nas salas de aula e nos laboratórios, coisa ainda proibitiva para uma enorme parcela da população mundial.
Texto: Ramon Lamar de Oliveira Junior
* As citações em alguns sites têm sido referidas a Ty Coplen (site da IUPAC), a Fabienne Meyers ou a Michael Wieser. Acho que ficaremos sem saber exatamente quem fez a afirmativa primeiro.

Putz, recordando as aulas de química do Prof. PK Ramon Lamar no Dom Silvério e NDA. Eita que o tempo passa rápido.
ResponderExcluirEssas mudanças já valem pra esse ano Ramon?
ResponderExcluirSou avesso a transformações sem GRAAAAANDE necessidade. Essa é mais uma delas não é?!
Abração professor
Saulo,
ResponderExcluirmais vale saber do que se trata do que se preocupar com a "nova" tabela. Como eu disse, de pouco impacto para vocês.
Abraços.
Ramon, achei seu texto incrível. O fato de 2011 ser o AIQ e a busca por tirar a química da obscuridade com modificações de pesos atômicos é absolutamente equivocada!
ResponderExcluir